本文
新型コロナワクチン接種に係る副反応疑い報告の状況について
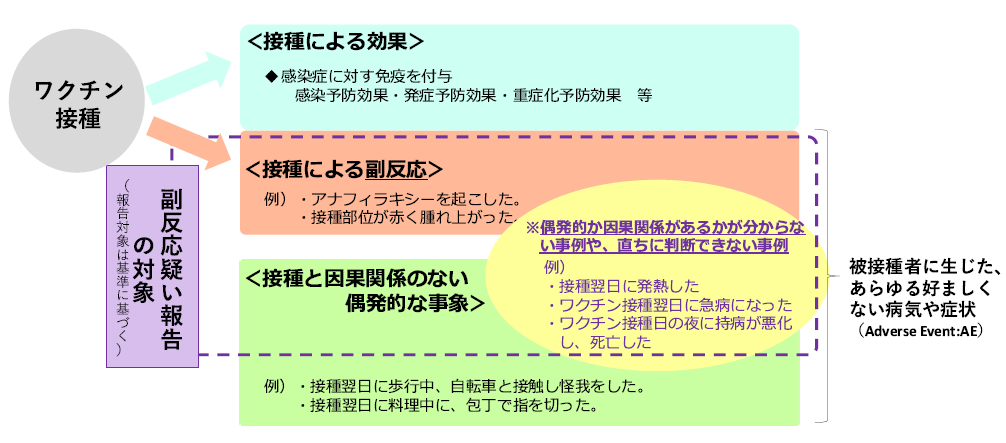
副反応疑い報告の概要
国が、ワクチンの接種後に生じうる副反応を疑う事例について、医療機関に報告を求め、収集しています。
報告された事例は、国の審議会に報告され、専門家による評価を行います。国は、こうした結果を公表するなどして、安全性に関する情報提供などを行っていきます。
- ワクチンの接種後には副反応を生じることがあり、副反応をなくすことは困難です。
接種によって得られる利益と、副反応などのリスクを比較して接種の是非を判断する必要があります。 - 副反応疑い報告では、ワクチンと関係があるか、偶発的なもの・他の原因によるものかが分からない事例も数多く報告されます。
国では、透明性の向上等のため、こうした事例も含め、報告のあった事例を公表しています。
報告の主体
報告の対象となる症状の発生を知った、医師又は医療機関の開設者は、予防接種法第12条に基づき、国に報告しなければならないこととされています。
報告の基準
報告の対象となる症状は次のとおりです。
- アナフィラキシー(ワクチンとの関連によらず、接種後4時間以内に発生した場合が報告の対象)
- 血栓症(血栓塞栓症を含む。)(血小板減少症を伴うものに限る。)(ワクチンとの関連によらず、接種後28日以内に発生した場合が報告の対象)
- 心筋炎(ワクチンとの関連によらず、接種後28日以内に発生した場合が報告の対象)
- 心膜炎(ワクチンとの関連によらず、接種後28日以内に発生した場合が報告の対象)
- 熱性けいれん(ワクチンとの関連によらず、接種後7日以内に発生した場合が報告の対象)
- 医師が予防接種との関連性が高いと認める症状であって、以下に該当するもの(予防接種との関連性が高いと医師が認める期間に発生した場合が報告の対象)
・入院治療を必要とするもの
・死亡、身体の機能の障害に至るもの
・死亡若しくは身体の機能の障害に至るおそれのあるもの
ワクチン接種との因果関係が示されていない症状も含め、幅広く評価を行うため、当面の間、以下の症状について、報告を積極的に検討することとなっています。
けいれん(ただし、熱性けいれんを除く。)、ギラン・バレ症候群、急性散在性脳脊髄炎(Adem)、血小板減少性紫斑病、血管炎、無菌性髄膜炎、脳炎・脳症、関節炎、脊髄炎、顔面神経麻痺、血管迷走神経反射(失神を伴うもの)
医療機関の皆さまへ
報告された事例と評価について
全国の副反応疑い報告の状況
定期接種及び任意接種に係る報告件数
国の厚生科学審議会予防接種・ワクチン分科会副反応検討部会が令和7年7月25日に開催され、令和6年4月1日以降の新型コロナワクチンの定期接種及び任意接種について、令和6年4月1日から令和7年3月31日までの副反応疑い報告状況が報告されました。報告内容は次のとおりです。
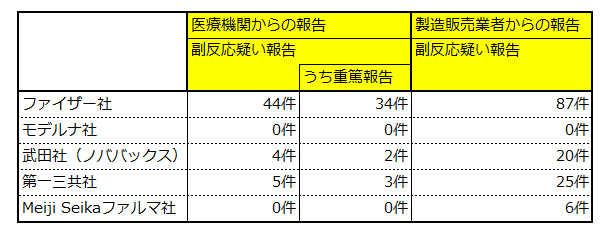
※医療機関からの報告と製造販売業者からの報告で、重複する症例は、医療機関からの報告として計上しています。
令和6年3月31日までの特例臨時接種に係る報告件数
国の厚生科学審議会予防接種・ワクチン分科会副反応検討部会が、令和6年10月25日に開催され、令和6年8月4日までに副反応疑い報告として、国に報告された事例は次のとおりです。
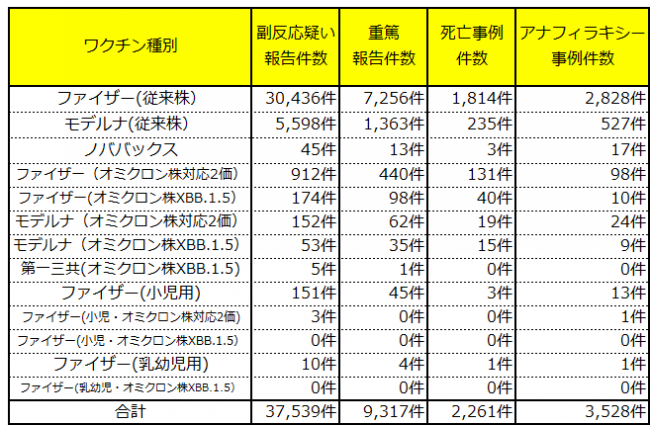
※死亡事例件数は製造販売業者の報告件数を含みます。
※オミクロン株対応2価とは、従来株に由来する成分とオミクロン株に由来する成分の両方を含む「2価ワクチン」で、BA.1対応型とBA.4-5対応型の2種類があります。
アストラゼネカ社ワクチンの件数
国の厚生科学審議会予防接種・ワクチン分科会副反応検討部会が、令和4年11月11日に開催され、令和4年10月9日までに副反応疑い報告として、国に報告されたアストラゼネカ社ワクチンの事例は次のとおりです。

〈参考〉厚生労働省厚生科学審議会(予防接種・ワクチン分科会 副反応検討部会)の資料一覧(厚生労働省のサイト)
岡山県内の副反応疑い報告の状況(国からの情報提供)
定期接種に係る報告件数
令和6年4月1日以降の新型コロナワクチン定期接種について、令和7年8月7日までに副反応疑い報告として、国から情報提供された事例はありません。
令和6年3月31日までの特例臨時接種に係る報告件数
副反応疑い報告として、独立行政法人 医薬品医療機器総合機構が令和6年8月4日までに受け付け、国を経由して岡山県に情報提供があった事例は次のとおりです。
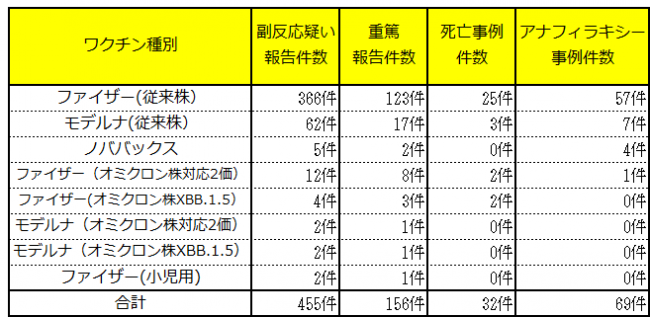
※オミクロン株対応2価とは、従来株に由来する成分とオミクロン株に由来する成分の両方を含む「2価ワクチン」で、BA.1対応型とBA.4-5対応型の2種類があります。
アストラゼネカ社ワクチンの件数
副反応疑い報告として、独立行政法人 医薬品医療機器総合機構が令和4年10月9日までに受け付け、国を経由して岡山県に情報提供があったアストラゼネカ社ワクチンの事例は次のとおりです。

その他
被接種者又は保護者の方は、予防接種後に発生した健康被害について、必要に応じて、市町村に報告する制度(報告様式 [PDFファイル/106KB])があります。
詳しくはお住まいの市町村にご相談ください。
